La historia de la tabla periódica de los elementos químicos se remonta a una necesidad que existía entre los químicos de buscar una clasificación de los elementos, no solo con objeto de facilitar el conocimiento de sus propiedades, sino, y más importante, para facilitar las investigaciones y los avances en el conocimiento de la materia.
¿Cómo se comenzó a usar la tabla periódica de los elementos? El descubrimiento de un gran número de elementos y el estudio de sus propiedades, puso de manifiesto las semejanzas que había entre algunos de ellos.
Esto indujo a los químicos cerca del año 1860 a buscar una clasificación de los elementos, no solo con objeto de facilitar su conocimiento, sino, y más importante, para facilitar las investigaciones y los avances en el conocimiento de la materia.
Para entender el proceso de cómo se clasificaron los elementos químicos, te proponemos el siguiente ejercicio: supongamos que tienes diferentes frutas: por ejemplo, mandarinas, manzanas, uvas, plátanos, ciruelas, limones y paltas. Ahora, clasifícalas.
¿Cómo lo harías? Tal vez las clasificarías por el tamaño, o tal vez por el color o sabor, y así seguirías organizándolas. Te darías cuenta de que existen varias posibilidades de clasificación, según el criterio que se use. Pero ahora imagina que cada fruta corresponde a un elemento químico. Aquí tendrías que agruparlos no por su color o sabor, sino por sus propiedades químicas.
Algo similar realizaron los antiguos químicos para clasificar los elementos químicos en la tabla periódica de los elementos.

Origen de la tabla periódica de los elementos
Los primeros trabajos de Dimitri Ivanovich Mendeleiev datan de 1860 y sus conclusiones fueron leídas en 1869, en la Sociedad Química Rusa. Él mismo resumió su trabajo en los siguientes postulados:
-Si se ordenan los elementos según sus pesos atómicos, estos muestran una evidente periodicidad.
Los elementos semejantes en sus propiedades químicas poseen pesos atómicos semejantes (K, Rb, Cs).
-La colocación de los elementos en orden a sus pesos atómicos corresponde a su valencia.
-Los elementos más difundidos en la naturaleza son los de peso atómico pequeño. Estos elementos poseen propiedades bien definidas.
-El valor del peso atómico caracteriza un elemento y permite predecir sus propiedades.
En determinados elementos puede corregirse el peso atómico si se conoce el de los elementos adyacentes.
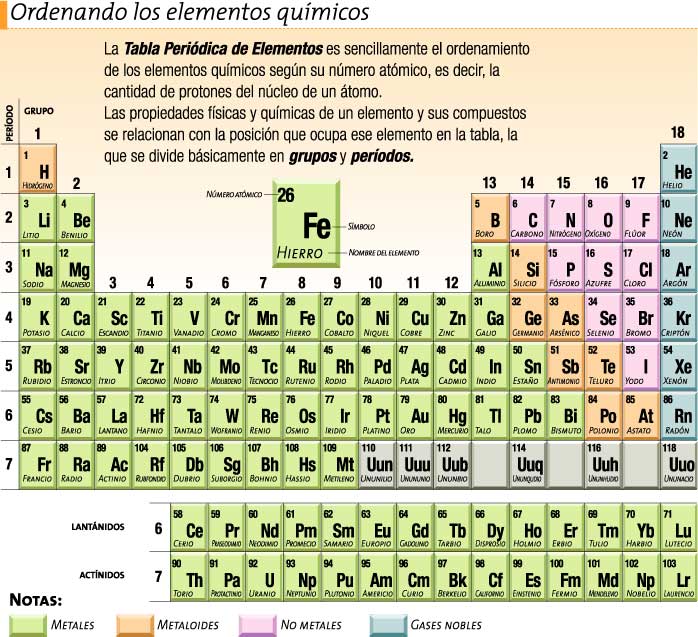
La tabla periódica moderna consta de siete períodos y ocho grupos.
-Período: cada franja horizontal.
-Grupo: cada franja vertical.
-Familia: grupo de elementos que tienen propiedades semejantes.
El sistema de Mendeléyev
Con el paso de los años y producto de los nuevos descubrimientos en la disciplina química, al modelo del científico ruso Dimitri Ivánovich Mendeléyev se le fueron reconociendo sus aciertos pero también algunos defectos.
Entre las ventajas se encuentran las siguientes:
-Corrigió los pesos atómicos y las valencias de algunos elementos, que no tenían lugar en su tabla, tal como eran considerados hasta entonces.
-Señaló las propiedades de algunos elementos desconocidos, entre ellos, tres a los que llamó eka-boro, eka-aluminio y eka-silicio.
-En 1894, William Ramsay descubrió un gas al que denominó argón. Este es monoatómico, no presenta reacciones químicas y carecía de un lugar en la tabla. Inmediatamente supuso que debían existir otros gases de propiedades similares y que todos juntos formarían un grupo. En efecto, poco después se descubrieron los otros gases nobles y se les asignó el grupo cero.
-Todos los huecos que dejó en blanco se fueron llenando al descubrirse los elementos correspondientes. Estos presentaban propiedades similares a las asignadas por Mendeléyev.

En cuanto a las inexactitudes que se le atribuyen a la tabla periódica de los elementos de Mendeleiev se encuentran las siguientes:
-No tiene un lugar fijo para el hidrógeno.
-Destaca una sola valencia.
-El conjunto de elementos con el nombre de tierras raras o escasas (lantánidos) no tiene ubicación en la tabla, o bien, se ponen todos juntos en un mismo lugar, como si fueran un solo elemento, lo cual no es cierto.
-No había explicación posible al hecho de que unos períodos contaran de 8 elementos, otros de 18, otros de 32, etc.
-La distribución de los elementos no está siempre en orden creciente de sus pesos atómicos.
Tabla periódica moderna
En el siglo pasado se descubrió que las propiedades de los elementos no son función periódica de los pesos atómicos, sino que varían periódicamente con sus números atómicos o carga nuclear. He aquí la verdadera ley periódica moderna, por la cual se rige el nuevo sistema: “Las propiedades de los elementos son función periódica de sus números atómicos”.
Modernamente, el sistema periódico se representa alargándolo en sentido horizontal lo suficiente para que los períodos de 18 elementos formen una sola serie. Este sistema periódico largo (la clasificación de Werner) es el más aceptado ya que permite apreciar más fácilmente la periodicidad de las propiedades de los elementos.
Elementos químicos en la vida diaria
Denominados también elementos de la vida o bioelementos (biogenésicos), están presentes en todos los seres vivos. De todos los elementos de la tabla periódica, solo unos 25 son componentes de los seres vivos. Esto confirma la idea de que la vida se ha desarrollado sobre unos elementos concretos que poseen unas propiedades físico-químicas idóneas con los procesos químicos que se desarrollan en los seres vivos.
Los bioelementos se agrupan en tres categorías, atendiendo a su abundancia (no a su importancia):
-Bioelementos primarios o principales: son los elementos mayoritarios de la materia viva; constituyen el 95% de la masa total. Estos son: el carbono (C), hidrógeno (H), oxígeno (O) y el nitrógeno (N).
-Bioelementos secundarios: son el azufre (S), fósforo (P), magnesio (Mg), calcio (Ca), sodio (Na), potasio (K) y cloro (Cl). Los encontramos formando parte de todos los seres vivos y en una proporción de 4,5%.
-Oligoelementos: son aquellos elementos químicos que se encuentran presentes en forma residual. Son muy escasos o están en pequeñísimas cantidades. En los seres vivos se han aislado unos 60 oligoelementos, pero solamente 14 de ellos pueden considerarse comunes para casi todos. Estos son: hierro (Fe), manganeso (Mn), cobre (Cu), zinc (Zn), flúor (F), yodo (I), boro (B), silicio (Si), vanadio (V), cromo (Cr), cobalto (Co), selenio (Se), molibdeno (Mb) y estaño (Sn).
Propiedades periódicas de los elementos
Son propiedades periódicas de los elementos químicos las que se desprenden de los electrones de cadena de valencia o electrones del piso más exterior. Estas son las siguientes:
– Radio atómico: es la distancia de los electrones más externos al núcleo.
– Afinidad electrónica: es la energía desprendida por un ion gaseoso que recibe un electrón y pasa a átomos gaseosos.
– Elementos electropositivos: son aquellos que tienen tendencia a perder electrones transformándose en cationes; a ese grupo pertenecen los metales.
– Elementos electronegativos: son los que toman con facilidad electrones transformándose en aniones; a este grupo pertenecen los metaloides.
Los elementos más electropositivos están situados en la parte izquierda del sistema periódico; son los llamados elementos alcalinos. A medida que se avanza en cada período hacia la derecha va disminuyendo el carácter electropositivo, llegándose, finalmente, a los alógenos de fuerte carácter electronegativo.
Camino hacia la tabla periódica
Durante siglos los químicos trataron de clasificar los elementos químicos. Algunos de estos intentos fueron:
– Primera tentativa de clasificación: triadas de Döbereiner. Entre 1817 y 1829, Johann Wolfgang Döbereiner expuso su ley de las triadas, agrupando de tres en tres elementos con propiedades semejantes.
– Segunda tentativa de clasificación: ley de las octavas de Newlands. En 1864, John Alexander Newlands observó que, dispuestos los elementos en orden creciente de sus pesos atómicos, después de cada siete elementos, en el octavo se repetían las propiedades del primero, y por analogía con la escala musical enunciaba su ley de las octavas.
– Tercera tentativa de clasificación: sistema periódico de Mendeleiev. Fue el químico ruso Dimitri Ivanovich Mendeleiev el que, comprendiendo el alcance de la ley periódica, estableció la tabla periódica de los elementos.