Podemos clasificar la materia por el tipo de componentes que contiene, por tanto podemos subdividirla en Sustancias Puras y Mezclas.
1. Sustancias Puras: Formadas por un solo tipo de sustancia, poseen una composición fija o definida en los diferentes estados físicos de la materia (Líquido, sólido y gaseoso), presentan propiedades características, como la temperatura de ebullición (específica y constante) o la densidad. Estas pueden ser, los elementos y compuestos químicos.
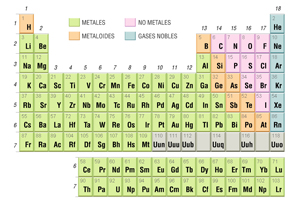
a) Elementos Químicos: Sustancias simples compuestas por un solo tipo de partículas (átomos) y no se pueden descomponer en otras sustancias más sencillas. Se representan mediante símbolos en la tabla periódica (Figura 1), por ejemplo el Oxígeno (O), el Zinc (Zn), el cobre (Cu), el carbono (C), el sodio (Na), entre otros.
Al unirse dos o más átomos iguales, éstos formarán moléculas, tales como el Ozono (O3) o el Nitrógeno gaseoso (N2).

b) Compuestos Químicos: Unión de dos o más sustancias (átomos) diferentes, en cantidades fijas y exactas. Se pueden descomponer en sustancias más simples a través de métodos químicos. Se representan mediante fórmulas químicas que expresan las cantidades y tipos de elementos químicos que los componen (Figura 2).

2. Mezclas: Combinación de dos o más sustancias puras, que pueden estar en cantidades variables conservando sus propiedades individuales. Sus componentes pueden ser separados u obtenidos mediante métodos físicos. Se clasifican en Mezclas Homogéneas y Mezclas Heterogéneas.
a) Mezclas Homogéneas: Son mezclas cuyos componentes se encuentran distribuidos de manera uniforme o en una fase y no se pueden distinguir a simple vista. Se denominan también Diluciones Químicas, ya que se encuentran formadas por soluto (que está en menor proporción) y un disolvente (líquido mayoritariamente) que se encuentra en mayor proporción en una solución. Ejemplos: El vinagre (Solución líquida), el aire (solución gaseosa), el agua con sal después de ser revuelto (solución líquida), el Acero (Solución sólida), el agua potable (solución líquida), Jabón (Solución sólida), entre otros. Figura 3.

b) Mezclas Heterogéneas: En ellas se pueden observar a simple vista o con instrumentos de laboratorio los componentes que la constituyen, porque estos se distribuyen en forma irregular o en fases (figura 4). Dentro de éstas se encuentran los Coloides y las Suspensiones:

– Suspensiones: Son mezclas en donde una sustancia o partícula es visible en una solución, porque esta no se disuelve en un medio líquido o solvente. Ejemplos: Sangre, jugos de frutas naturales, polvo en el aire, entre otros (Figura 5).

– Coloides: Son mezclas que poseen partículas muy pequeñas, que sólo son vistas con un buen microscopio electrónico, se encuentran en constante movimiento y choque entre ellas en el medio que las contiene. Ejemplos: Leche, Jalea, Mayonesa, Aceite emulsionado, entre otros (Figura 6).

Para profundizar:
http://www.youtube.com/watch?v=w4C-dDnFctA
http://recursostic.educacion.es/newton/web/materiales_didacticos/sustancias_puras_y_mezclas/materia.html?1&0







 Batalla de Lircay
Batalla de Lircay